چشم انداز ابرانسان سازی در مسابقه های پنهان و آشکار جهانی/پاسخ های برنده جایزه یونسکو به سوالاتی پیرامون مهندسی ژنتیک
مصاحبه اختصاصی آفتاب سلامت با پرفسور سودابه داوران:
درباره شناخت حافظه سلولی و بازنویسی DNA سلول، پیشرفت ها تا چه اندازه بوده و آیا واقعا دانشمندان بر دروازه دنیای بازسازی انسان ایستاده اند.
طبق نظریه «حافظه سلولی» هر کدام از سلول های بدن می تواند مستقل از مغز، خاطرات را حفظ کنند. بر اساس این نظریه، سلول ها قادرند ماهیت خود را به خاطر بسپارند. سلول ها تمام ژن هایی که می تواند آن ها را به سلول های مختلف تبدیل کند را دارا هستند. این ژن ها علاوه بر داشتن اطلاعات وراثتی می توانند اطلاعات مربوط به تجربیات حیاتی ما را حفظ کنند. برخی از موجودات زنده می توانند بافت ها و اندام های خود را بازسازی کنند. مثلا مارمولاک ها و سمندر ها می توانند بخش هایی از دست، دم، چشم و مغز و نخاع خود را پس از آسیب دیدن مجددا باز سازی کنند.
سوال این است که چگونه یک بافت می تواند شکل قبلی خود را به یاد داشته باشد و بداند تا چه زمان باید به تکثیر ادامه دهد؟
تحقیق بر روی گونه های مختلف نشان داده است که بافت ها می توانند اطلاعات حالات قبلی خود را حفظ کنند که این اطلاعات شامل محل آناتومیک بافت و علایمی است که به سلول های اطراف، ارسال و دریافت نموده است.
هر سلول، علایمی از سلول های اطراف دریافت می کند و برآیند این علایم یا سیگنال ها باعث می شود که پس از قطع عضو، سلول، سیگنال های جدید و سیگنال های مربوط به قبل از قطع عضو را در جریان بازسازی به یاد داشته باشد. بنابراین این باور که حافظه فقط در مغز قرار دارد متحول شده است.
در مواردی که جراح مجبور شده بخش هایی از مغز بیمار را خارج کند، ملاحظه شده که حافظه هنوز وجود دارد و یا تعدادی از بیمارانی که در جریان اهدای عضو به ویژه اهدای قلب، گیرنده بوده اند، اظهار نموده اند که برخی عادات و روحیات آن ها عوض شده است. به نظر می رسد سلول های بافت دریافت شده، خاطرات اهدا کننده خود را حفظ کرده است. برخی از محققین بیولوژی سلولی معتقدند که خاطره ی سلولی بد می تواند منجر به بروز بیماری هایی مثل سرطان، اعتیاد، افسردگی و غیره شود و تغییر حافظه ی سلولی از بد به خوب می تواند جلوی ابتلا به برخی بیماری ها را بگیرد. در این راستا محققان توانسته اند با سرکوب کردن برخی ژن ها، حافظه سلولی را پاک کنند و آن را به بازآرایی برنامه نویسی وادارند CREPROGRAMMING بنابراین انتقال الگوی ژنی از نسلی به نسل دیگر فقط از طریق توالی DNA سلول ها نیست بلکه فرایند های دیگری که توارث فرا ژنی و حافظه سلولی نام دارند نیز دخیل هستند. سلول های بنیادی، خاطرات تکوین خود را تا تبدیل شدن به سلول های تخصصی حفظ می کنند. در فرایند فرا ژنی واکنش های بیوشیمیایی مرتبط با دمیتلاسیون DNA دخیل هستند. می توان گفت حافظه سلولی مثل یک بیو کامپیوتر است و مانند یک هارد دیسک عمل می کند که اطلاعات در آن ذخیره شده اند. این دیسک، تمام اطلاعات سلولی را که در بدن ما اتفاق افتاده است نگه داشته است و عکس العمل بدن ما را نسبت به محیط خارج، نحوه تعامل ما را با انواع استرس ها و چالش های جسمانی و روانی تحت تاثیر قرار می دهد.
مالک یکی از شرکت های داروسازی آمریکایی عنوان کرده که شرکت وی با مهندسی خاصی توانسته مانع کوتاه شدن تلومرها در سلول های بدن وی شود و اینک تلومرهای سلولی او در سن ۴۵ سالگی مانند ۲۰ ساله ها هستند. آن ها عنوان کرده اند راز جوان ماندن را در حفظ طول تلومرها می دانند و روی آن تمرکز کرده اند در حالی که دانشمندان دیگری با تحت تاثیر قرار دادن میتوکندری ها از آنتی اکسیدان های مصنوعی تحت عنوان SKQ1 مدعی چندبرابر کردن عمر برخی موجودات هستند و عنوان می کنند که راز جوانی در محافظت از میتوکندری هاست.
گمانه زنی شما درباره چگونگی جلوگیری از کوتاه شدن تلومرها چیست؟ آیا چنین اقدامی با توجه به توانایی مهندسی ژنتیک در این مقطع زمانی امکان پذیر است؟ استفاده از آنتی اکسیدان های مصنوعی در شاداب نگه داشتن میتوکندری ها را توضیح دهید؟
تلومرها، کمپلکسDNA –پروتئین در دو انتهای کروموزوم هستند و ژنوم را از متلاشی شدن یا به هم پیوستن داخل کروموزومی محافظت می کنند.
در هر بازنویسی DNA، تلومرها کوتاه تر می شوند و با تکرار فرایند تقسیم سلولی، آسیب پذیری سلول ها تشدید شده و این فرایند فرسایشی نهایتا مرگ سلول را رقم می زند. بنابراین تلومرها مانند بمب ساعتی ژنتیکی عمل می کنند. تحقیقات مختلف نشان داده اند که ارتباط معنی داری بین طول تلومرها و طول عمر وجود دارد. افرادی که تلومرهای کوتاه تری دارند بیشتر از افرادی که تلومرهای بلند دارند بیمار می شوند. برخی از سلول های بدن، نامیرا هستند. این سلول ها دارای آنزیمی به نام «تلومراز» می باشند که می تواند توالی تلومری در انتهای کروموزوم ها را بسازد. این آنزیم در سلول های جوان وجود دارد و با پیر شدن سلول ها از بین می رود.
در سلول های نامیرا مثل تخمک، اسپرم و برخی سلول های ایمنی، فعالیت «تلومراز» ثابت است و کاهش نمی یابد. بنابراین برخی محققین اعتقاد دارند که با فعال کردن این آنزیم در تمام سلول ها می توان فرآیند پیری را متوقف یا معکوس کرد.
طول تلومرها در انسان با نابودی ۷/۲۷ تا۸/۲۴ جفت از بازهای سازنده آن در هر سال، به طور مستمر روند کوتاه تر شدن را می پیماید.
کوتاه شدن تلومرها با عواملی از قبیل بیماری، ژنتیک، ساختار فراژنی محیط، وضعیت اجتماعی و اقتصادی، ورزش، وزن بدن و استعمال دخانیات ارتباط دارد. جنسیت، تاثیر چندانی در کوتاه شدن تلومرها ندارد. وقتی طول تلومر کوتاه تر از یک حد بحرانی شود سلول دچار آپوپتوز می شود.
سبک زندگی و فاکتورهایی از قبیل سیگار کشیدن، فقدان ورزش و رژیم غذایی نامناسب و اعتیاد سبب کوتاه شدن تلومرها شده منجر به بیماری و یا مرگ می شود.
با تسریع روند کوتاه شدن تلومرها، ریسک بیماری های قلبی-عروقی، ایست قلبی، دیابت و سرطان و پوکی استخوان افزایش می یابد. مورتالیتی (مرگ و میر) در افراد بزرگ سالی که تلومرهای کوتاه تر دارند بیشتر مشاهده شده است. اعتیاد به مواد مخدر و تاثیر عوامل محیطی مضر از قبیل آلودگی هوا، قرار گرفتن در معرض برخی مواد شیمیایی مضر، مانند بنزن تولوئن طول تلومرها را کاهش می دهد. استرس ها و فشارهای عصبی سبب آزاد شدن گلوکو کورتیئویدها توسط غدد آدرنال می شود. این هورمون ها سطح پروتئین های آنتی اکسیدان را کاهش می دهند و آسیب اکسیداتیو به DNA را افزایش داده منجر به کوتاه شدن طول تلومرها می شوند. زنانی که در زندگی روزانه خود استرس بیشتری متحمل می شوند فعالیت تلومری کمتری دارند و تلومرهای کوتاه در سلول های خونی باعث افزایش ریسک بیماری های مرتبط با سن می شود. طول تلومری سلول های لوکوسیت به طور قابل ملاحظه ای با رژیم غذایی مرتبط است. الیاف، سبب بلند شدن طول تلومرها و چربی ها سبب کاهش آن می شوند. کاهش ۴۰ درصد پروتئین در غذا منجر به افزایش ۱۵ درصد در طول عمر می شود.
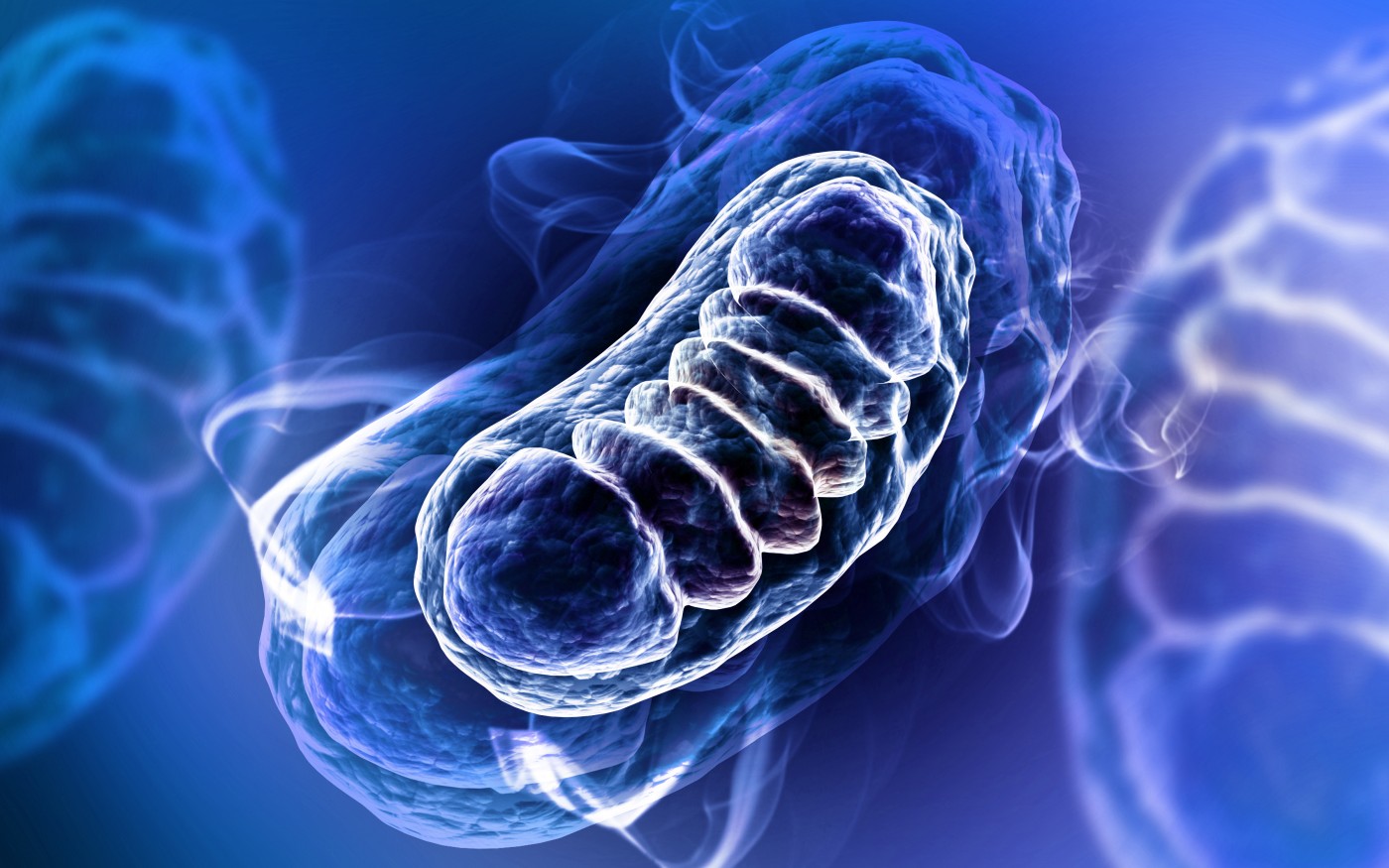
میتوکندری ها ایستگاه انرژی داخل سلولی بوده و نقش مهمی در پیر شدن سلول ها و کنترل مرگ و زنده مانی سلول ها بر عهده دارند. اختلال در عملکرد میتوکندری ها منجر به بروز بیماری هایی از قبیل سکته و دیابت می شود. در میتوکندری ها گونه های فعال اکسیژنROS تولید می شود که می تواند آسیب جدی به سلول ها وارد کند. تولید اکسیژن فعال در فرآیند پیری پستانداران، نقش کلیدی دارد. می توان با هدف قرار دادن میتوکندری ها با ترکیبات آنتی اکسیدان، روند پیری را کند نمود. از ترکیبات آنتی اکسیدان متداول، می توان ویتامین هایی مثل اسکوربیک اسید، توکومزول، بتاکاروتن، سلینم و آنتی اکسیدان های مصنوعی هیدروکسی آنیزول بوتیله (BHA) را نام برد. پلی فنل های گیاهی نیز نوعی آنتی اکسیدان طبیعی محسوب می شوند.
گروهی از دانشمندان دانشگاه ایالتی مسکو توانسته اند با استفاده از آنتی اکسیدان سنتزی به نام SRQ1 روند پیری را در موش هایی که به طریق ژنتیکی طول عمر آنها کاهش داده شده بود بسیار کند کنند. موش معمولی، طول عمری در حدود یک سال دارد. طول عمر موش هایی که توسط محققان، تغییر ژنتیکی داده شده بودند به طور قابل ملاحظه ای کاهش یافته بود تا فرآیند پیری با سرعت بیشتری مطالعه شود. محققان روسی این موش ها را به گروه کنترل و گروهی که در آب آشامیدنی آن ها آنتی اکسیدان مصنوعی SRQ1 وارد شده بود تقسیم کردند. اختلاف طول عمر دو گروه، به صورت قابل ملاحظه ای مشاهده گردید.
گروه کنترل، مراحل عادی پوکی استخوان و کاهش وزن را گذراندند اما علائم پیر شدگی در موش هایی که آنتی اکسیدان دریافت کرده بودند بسیار دیرتر بروز نمود.
بنابراین نقش گونه های اکسیژن فعال که در میتوکندری تولید می شوند و اثر آنتی اکسیدان های طبیعی و مصنوعی، ممانعت از عملکرد منفی این گونه های فعال کاملا مشخص است. داروهایی که خاصیت آنتی اکسیدان دارند و می توانند میتوکندری ها را هدف قرار دهند، در افزایش طول عمر و کاهش روند پیری موثر هستند.
اخیرا موفقیت های مستندی در کند کردن روند پیری در موش ها حاصل شده که در مجلات معتبر پزشکی انعکاس زیادی داشته است. با توجه به شباهت های ژنوم موش به ژنوم انسان، آیا می توان امیدوار بود که عمر انسان در دهه آینده به ۱۵۰ تا ۲۰۰ سال افزایش پیدا کند؟
طبق تحقیقات جدید، ثابت شده است که می توان روند پیری را حداقل در موش ها متوقف کرد یا حتی معکوس نمود. در دانشگاه هاروارد بوستون تحقیقاتی روی موش های تغییر یافته ژنتیکی انجام گرفته است که پس از دریافت «تلومراز» بعد از بلوغ، جوان تر شده اند. به نظر می رسد همین روال را می توان در انسان به کار برد.
اگر ژن ها طوری تنظیم شوند که سلول های بالغ به سلول های امبریونیک (رویانی) تبدیل شوند، می توان روند پیری را معکوس نمود. این تحقیق در آزمایشگاه، بر روی سلول های موش و انسان در موسسه ی مطالعات بیولوژی SAIR انجام گرفته است.
تغییر در بازآرایی برنامه نویسی اپی ژنیک (تغییراتی که در سطح بیان ژنی در ژنوم اتفاق می افتند) می تواند منجر به معکوس شدن پیری شود. توالی DNA در سلول ها تغییر پذیر نیست اما فاکتور های اپی ژنیک را می توان تغییر داد. مواردی کشف یا تهیه شده اند که تغییرات اپی ژنیک را متوقف می کنند و مانع از پیری می شوند. (تغییرات اپی ژنیک تغییراتی ژنتیکی هستند که در هنگام بیان ژن رخ می دهند و منجر به تغییر ضوتیپ شده بدون این که ژنوتیپ تغییر کند). این تغییرات که می توانند منجر به انواع بیماری ها شوند قابل کنترل بوده و در جلوگیری از پیری و برگرداندن آن به کار گرفته شده اند. دانشمندان در دهه اخیر توانستند سلول های پیر پوست یک موش بالغ را با افزودن چهار پروتئین به نام «فاکتورهای یاماکانا» به سلول های جنینی رویانی تبدیل کنند و مجددا آن ها را جوان نمایند. این پروتئین ها در واقع می توانند سلول ها را وادار به بازآرایی برنامه نویسی کنند و تغییرات اپی ژنیک را که منجر به پیری سلول ها می شوند کنترل نموده و به نوعی حافظه ی سلولی را پاک کنند. بنابراین می توان امیدوار بود که در آینده نه چندان دور بتوان عمر انسان را تا ۲۰۰ سال افزایش داد و حتی فرآیند پیری را معکوس نمود.
دکتر سودابه داوران
رییس آزمایشگاه و عضو موسس مرکز تحقیقات نانوتکنولوژی دارویی دانشگاه علوم پزشکی تبریز


